STANDARD: Frau Knapp, bekommen Immunforscher wie Sie eigentlich die Grippe?
Knapp: Sicher. Wenngleich ich sie nicht bekommen habe – ich habe mich allerdings impfen lassen. Beziehungsweise: Ich habe mich selbst geimpft.
STANDARD: Ist es bei der Grippeimpfung nicht immer ein bisschen unklar, ob sie wirkt oder nicht?
Knapp: Das stimmt, die Grippeviren verändern sich. Die Moleküle auf ihrer Oberfläche, die für die Impfung verwendet werden, sind sehr unterschiedlich. Und es ist nie ganz sicher, welcher Stamm nun derjenige ist, der für die meisten Erkrankungen des Folgejahres verantwortlich sein wird. Meistens treffen die Voraussagen gut zu, nur vergangenes Jahr hat es nicht ganz gestimmt. Die neuesten Daten zeigen, dass der Impfschutz gegen H3N2 auch heuer nur bei 40 bis 50 Prozent liegt.
STANDARD: Warum haben andere Impfungen gegenüber Viren – etwa bei den Pocken – eine viel bessere Trefferquote?
Knapp: Das liegt an der Veränderungsrate der Erreger. Bei Grippeviren entstehen laufend neue Mutanten. Bei Pocken oder Gelbfieber gibt es kaum Veränderungen, deshalb kann man hier langfristig wirksame Impfstoffe herstellen. Ähnliches gilt für Hepatitis: Auch da reicht es oft aus, nur einmal im Leben zu impfen, weil sich die Impfung gegen stabile Proteine der Viren richtet. Anders ist das etwa bei Bakterien: Bei Pneumokokken werden zum Beispiel Zuckermoleküle für die Impfung verwendet. Die 23 häufigsten davon sind durch die Impfung abgedeckt, der Rest – das sind etwa 40 – ist davon nicht betroffen. Diese restlichen Typen vermehren sich infolge der Impfung auch besser. Was dazu führt, dass man irgendwann einen neuen Impfstoff entwickeln muss.
STANDARD: Wo sind eigentlich die Grippeviren im Sommer?
Knapp: In Südostasien. Oder besser gesagt: Sie sind im Sommer auch hier, aber in Europa können Sie sich während des Sommers nicht so gut ausbreiten. In Südostasien können sie sich hingegen immer vermehren.
STANDARD: Das heißt, Südostasiaten haben das ganze Jahr Grippe?
Knapp: Im Prinzip schon, zumindest herrscht das ganze Jahr über das Risiko, sich anzustecken. Die meisten Grippewellen haben ja in dieser Region ihren Ursprung.
STANDARD: Kommen wir nun zu einer Studie, die sie kürzlich im Fachblatt "Nature Immunology" veröffentlicht haben. Darin haben Sie die Ursachen der hohen Infektionsneigung bei "Hämolyse" aufgeklärt: Was passiert bei dieser Erkrankung – und wo tritt sie auf?
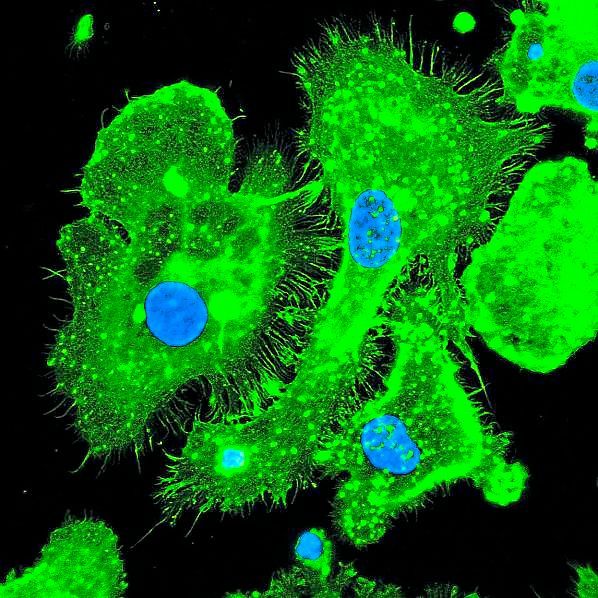
Knapp: Hämolyse beschreibt das Zerplatzen roter Blutkörperchen. Normalerweise werden rote Blutkörperchen 100 Tage alt und danach von Fresszellen in der Milz entsorgt. Bei der Hämolyse zerplatzen sie vorzeitig – zum Beispiel, wenn der rote Blutfarbstoff krankhaft verändert ist, wie etwa bei Sichelzellerkrankungen oder Thalassämie. Die roten Blutkörperchen können auch bei starken Entzündungen zerplatzen. Ist das der Fall, wird der rote Blutfarbstoff inklusive dem darin enthaltenen eisenhältigen Häm-Molekül freigesetzt. Dieses Häm-Eisen ist sehr reaktiv und kann zu Schädigungen der Zellen führen. Wir konnten nachweisen, dass dadurch auch Immunzellen in Mitleidenschaft gezogen werden.
STANDARD: Eine alte Hypothese lautet: Das Eisen aus dem Blutfarbstoff ist Nahrung für die Bakterien und fördert daher auch Infektionen – das haben Sie nun widerlegt, oder?
Knapp: Ja, genau. Je stärker die Hämolyse, desto mehr bakterielle Infektionen gibt es. Kinder mit Sichelzellanämie – diese Erkrankung kommt vor allem in Westafrika vor – haben sehr hohe Infektionsraten und eine Kindersterblichkeit von 40 Prozent. Früher hat man gedacht, das ist so, weil die Bakterien das bei Hämolyse freigesetzte Eisen für ihren Stoffwechsel verwenden können und sich somit besser vermehren. Aber das eigentliche Problem an dem freigewordenen Häm-Eisen ist: Es bringt das Zytoskelett von Fresszellen in Unordnung und lähmt sie: Die Fresszellen werden innerhalb von Minuten flach, breit und bewegungsunfähig. Fresszellen sind normalerweise dazu da, an Entzündungsorte zu wandern und dort Bakterien zu eliminieren. Sind sie dazu nicht imstande, nehmen die Infektionen überhand – mit fatalen Auswirkungen. Das Infektionsproblem bei Menschen mit Hämolyse ist riesig, weshalb bei Kindern mit Sichelzellanämie die jahrelange prophylaktische Gabe von Antibiotika empfohlen wird. Wir haben jetzt nachgewiesen, dass es eine sinnvolle Alternative gäbe: Man kann Infektionen abblocken, indem man das Immunsystem gegen die lähmenden Häm-Eisen-Effekte schützt und somit wieder reaktiviert.
STANDARD: Ist das auch bei Malaria der Fall?
Knapp: Ja, hier ist es ähnlich. Die Plasmodieninfektionen führen zur Auflösung der roten Blutkörperchen. Ein hoher Prozentsatz der Betroffenen – insgesamt sind das mehr als eine Million Menschen pro Jahr – stirbt nicht an der Malaria, sondern an sekundären Bakterieninfektionen.
STANDARD: Wie würde hier eine Behandlung funktionieren? Würde man versuchen das Häm-Eisen zu binden oder die Immunzellen mit einer "Rüstung" ausstatten?
Knapp: Beides funktioniert, weil man damit verhindern kann, dass das Häm-Eisen-Molekül die Immunzellen paralysiert – das ist der zentrale Mechanismus, der unterbunden werden muss.
STANDARD: Sie haben in Ihrer Arbeit eine recht grundlegende Annahme widerlegt. Ist das Immunsystem überhaupt schon ausreichend verstanden?
Knapp: Große Teile des Immunsystems werden sehr gut verstanden – aber es gibt noch jede Menge an Wissenslücken. Wir dürfen auch nicht vergessen, dass wir allgemein akzeptierte Annahmen, wie zum Beispiel jene, dass Hämolyse schlicht Futter für Bakterien bedeutet, hinterfragen müssen. Unsere Entdeckung ist wichtig, weil wir erst jetzt mit diesem neuen Wissen an einer gezielten Behandlung und Prophylaxe für Menschen mit Hämolyse arbeiten können. Man darf eben nicht aufhören, genau nachzuschauen, was die wirklichen Ursachen für Krankheiten sind.
Sylvia Knapp (48) hat an der Medizinischen Universität Wien sowie an der Freien Universität Berlin Medizin studiert und ihren PhD an der Universität Amsterdam absolviert. Seit 2012 ist sie Professorin für Infektionsbiologie an der Med-Uni Wien, seit 2006 forscht sie auch am Zentrum für Molekulare Medizin (CeMM) der österreichischen Akademie der Wissenschaften in Wien, dem sie seit 2015 als Direktorin für medizinische Angelegenheiten angehört. Zu ihren Forschungsgebieten zählen: Bakterieninfektionen, Entzündungen sowie Wechselwirkungen zwischen Wirt und Krankheitserregern. (Robert Czepel, 27.2.2017)