Dank einer Gentherapie führt Hassan heute ein weitgehend normales Leben und geht zur Schule. Vor drei Jahren noch war er dem Tode nahe, denn er leidet an der seltenen Schmetterlingskrankheit, die seine Haut aufgrund eines Genfehlers so empfindlich macht wie Insektenflügel. 2015 waren 60 Prozent seiner Hautoberfläche zerstört.
Ein Ärzteteam, darunter auch Johann Bauer von der Universitätsklinik Salzburg, wagten eine Gentherapie als Heilversuch. Sie isolierten Stammzellen aus Hassans Haut, schleusten das intakte Gen ein und züchten neue, gesunde Haut, die sie dem Jungen in drei Operationen transplantieren.
Seit dem ersten Gentherapieversuch vor fast 30 Jahren hat es immer wieder erstaunliche Erfolge, aber auch Rückschläge und Todesfälle gegeben. Forscher haben seither 2597 Studien über Gentherapien durchgeführt, und jährlich kommen mehr als 100 neue hinzu. Die meisten befinden sich im Versuchsstadium, aber in Europa wurden seit 2012 vier Gentherapeutika zugelassen. 2017 hat die amerikanische Arzneimittelbehörde erstmalig drei derartige Behandlungen zugelassen – wird also der Wunschtraum Gentherapie nun endlich wahr?
Viren als Gentaxis
Die initiale Idee hinter einer Gentherapie ist bestechend einfach: Vielen Krankheiten liegt ein einziger Genfehler zugrunde, der das entsprechende Protein funktionslos macht. Ersetzt man das fehlerhafte Gen durch ein intaktes, versetzt man die Zellen in die Lage, das Protein wieder korrekt zu produzieren.
"Das ist ungefähr so, als würde man einem Buch, in dem ein Druckfehler ist, einen Zettel mit den korrekten Worten beilegen und so die fehlerfreie Information hinzufügen", sagt Bernd Wissinger, Leiter des molekulargenetischen Labors der Universität Tübingen. Die Umsetzung der Idee in die Praxis hat allerdings ihre Tücken.
Eine harte Nuss ist bis heute der Transport eines intakten Gens in die entsprechenden Zellen. Man nutzt dazu Viren als Gentaxis, die keine Krankheiten mehr auslösen und sich nicht vermehren können. Allerdings erkennt das Immunsystem auch solche Viren und beseitigt sie rasch. Um also eine ausreichend große Zahl von Zellen mit einem intakten Gen zu versorgen, müssen Ärzte mehrere Billionen Gentaxis einsetzen – eine Virenschwemme, die der Körper im schlimmsten Fall nicht verkraftet. So geschehen bei Jesse Gelsinger.
Fatale Nebenwirkungen
Außerdem müssen Wissenschafter bis heute mit einem weiteren, enormen Haken leben: Niemand kann exakt vorhersagen, wo das Korrekturgen sich ins Erbgut einklinkt, was fatale Nebenwirkungen haben kann: 2006 gelang es zum Beispiel, zehn Kinder mit einer angeborenen, schweren Immunschwäche erfolgreich zu behandeln. Erst nach einigen Jahren zeigten sich verheerende Nebenwirkungen: Sieben der zehn Kinder hatten Blutkrebs entwickelt. Die Viren hatten das fehlerfreie Gen, das die Immunschwäche heilte, stabil ins Erbgut eingebaut, dabei aber Krebsgene aktiviert.
Das im Dezember 2017 in den USA zugelassene Gentherapeutikum Luxturna nutzt deswegen eine Virusart, die sich nicht in das Erbgut einklinkt, was das Leukämierisiko verringert. Luxturna hilft Patienten, die oft schon als Kinder erblinden. Ärzte spritzen das Gentherapeutikum direkt ins Auge, wo das intakte Gen den Verfall der Netzhaut verringert.
"Es ist keine Heilung, die hier erzielt wird – aber es gab eine klare, für den Patienten relevante Verbesserung, die dann hoffentlich auch anhält", so Wissinger, der kürzlich eine eigene Gentherapiestudie zur Behandlung der vollständigen Farbenblindheit beendet hat. "Die Patienten haben die Therapie gut vertragen. Ermutigend ist auch, dass einige sich gern das zweite Auge behandeln lassen wollen", sagt Wissinger.
Spektakuläre Fortschritte
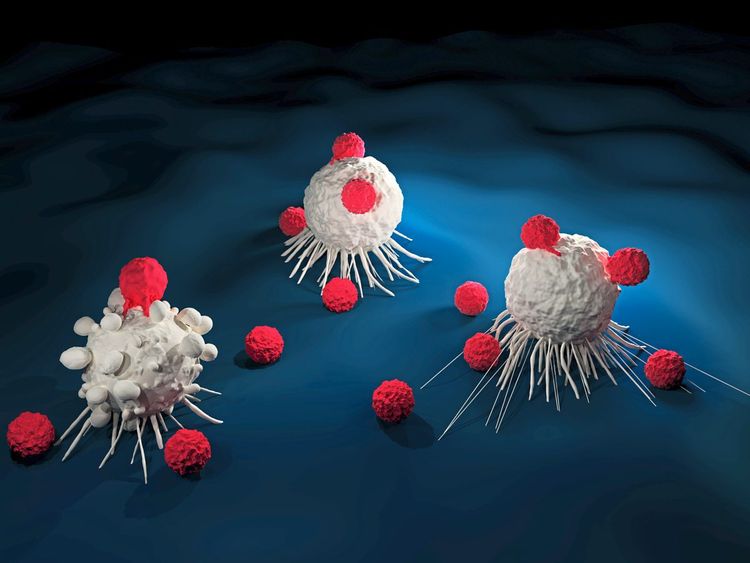
Spektakuläre Fortschritte hat es in den vergangenen Jahren auch bei der Behandlung bestimmter Krebsarten mithilfe der sogenannten CAR-T-Zellen gegeben. In den USA wurden 2017 zwei derartige Therapien, Kymriah und Yescarta, zur Behandlung von Leukämien zugelassen. Die Markteinführung in Europa steht bevor.
Ziel dieser Therapie ist die Vernichtung von Krebszellen mithilfe körpereigener T-Zellen, den Hauptakteuren der Immunabwehr. Anders als bei anderen Gentherapien wird hier aber kein Gendefekt korrigiert, sondern ein Gen hinzugefügt: Ärzte entnehmen Patienten T-Zellen, fügen das Gen für den Chimeric Antigen Receptor (CAR) ein und führen die veränderten T-Zellen wieder zurück. Den CAR kann man sich als Puzzlestück vorstellen, dessen Antikörperanteil aus den T-Zellen herausragt. Wenn nun die T-Zellen durch den Körper patrouillieren und das Puzzlestück sein Gegenstück findet – ein Antigenprotein auf der Oberfläche einer Krebszelle -, leitet das die Zerstörung der Tumorzelle ein.
Die CAR-T-Zelltherapie löst damit ein Grundproblem der Krebstherapie: Krebszellen lernen im Laufe der Zeit, sich für das Immunsystem unsichtbar zu machen. CAR-T-Zellen enttarnen sie und machen sie wieder angreifbar. Eine Ikone dieser Therapie ist Emily Whitehead, bei der im Alter von sechs Jahren eine nicht behandelbare Leukämie diagnostiziert wurde und die seit 2012 krebsfrei ist. Allerdings darf auch das Vorzeigebeispiel nicht darüber hinwegtäuschen, dass die CAR-T-Zelltherapie zum Teil massive Nebenwirkungen hat.
Einen Aufwind erhält die Forschung bezüglich Gentherapien auch durch die Genome-Editing-Verfahren, allen voran CRISPR/ Cas9. Statt es dem Zufall zu überlassen, wo sich ein Korrekturgen ins Erbgut einklinkt, kann man den Ort nun mithilfe der Genscheren präzis bestimmen. Ab und an schneiden auch die Genscheren daneben, ein Phänomen, das als Off-Target-Effekt bekannt ist.
Kosten und Nutzen
Obwohl immer mehr Gentherapien zugelassen werden, dürften sie auf absehbare Zeit nicht zur Routinemedizin gehören: "Die heutigen Gentherapien sind auf seltene Krankheiten und wenige Patienten beschränkt. Erst wenn sich die Therapien über längere Zeit als sicher und effektiv erweisen, kann man über andere Indikationen nachdenken", so Bauer.
Eine weitere Herausforderung sind die Kosten: Luxturna etwa kostet 850.000 US-Dollar (umgerechnet rund 700.000 Euro). Pharmaunternehmen rechtfertigen die Preise mit hohen Entwicklungskosten. Zudem hoffen sie, dass die Behandlung mehrere Jahre wirkt, im Idealfall lebenslang, womit Krankenkassen Kosten für andere Behandlungen einsparen können.
"Bei der Therapie von Hassan gehen wir derzeit von einer dauerhaften Heilung aus. Damit relativiert sich der Preis", sagt Bauer. Letztlich braucht es hier eine gesellschaftliche Diskussion: Was sind uns Gentherapien wert, die Blinde sehend machen, Krebskranke heilen und Leid ersparen? (Juliette Irmer, 18.5.2018)